바륨 [barium]
 2017-11-28
2017-11-28
원소기호 Ba, 원자번호 56, 원자량 137.33, 지각 중의 존재도 425ppm(13위), 안정핵종 존재비 130Ba=0.101%, 132Ba=0.097%, 134Ba=2.42%, 135Ba=6.59%, 136Ba=7.81%, 137Ba=11.32%, 138Ba=71.66%, 녹는점 725℃ , 끓는점 (약) 1,637℃ , 비중 3.5 (20℃), 전자배치 [Xe] 6s², 중요 산화수=2.
주기율표 2A족에 속하는 알칼리토금속 원소의 하나. 홑원소물질의 형태로는 산출되지 않지만 지각속에 칼슘광물에 수반하여 널리 분포하며 중요한 광석은 중정석(BaSO₄)과 독중석(BaCO₃)이다. 바륨을 함유하는 중정석이 무겁기 때문에 그리스어의 barys(무거운)를 따서 명명했다. 1809년, H. 데이비가 전기분해에 의해 아말감으로 추출했지만 순수한 바륨은 1901년에 처음으로 A. A. 건츠의 수소화바륨 분해로 얻었다.
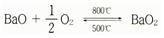
〔성질 · 용도〕 부드러운 은백색의 금속이며 모스굳기 2, 선팽창률 1.81~2.10×10-6/deg(0~300℃), 비저항 2.5×l04Ω · cm(18℃)이다. 체심입방격자(體心立方格子) 구조로 원자반지름 2.18Å이다. 크세논 같은 구조의 원자핵 바깥쪽에 두 개의 6s 전자가 있으며 이들을 쉽게 잃어 반지름 l.36Å(6배위일 때)의 바륨이온(Ba2+)이 된다. 이 이온화 경향은 동족원소의 칼슘이나 스트론튬보다 강하므로 바륨의 화학반응성은 이들 원소와 유사하지만 더욱 격렬하다. 공기 속에서 연소하여 산화바륨이 되고 그 속에는 약간의 과산화바륨(BaO2)도 함유된다. 산화바륨을 500℃ 로 가열하면 과산화바륨이 되고 이것을 800℃로 가열하면 산화바륨이 된다.
 금속바륨은 불과 반응하여 수소를 발생하고 수산화바륨(Ba(OH)2)이 된다.
Ba+2H2O → Ba(OH)2+H2
또한 에틸알코올과도 같은 형태의 반응을 하여 알콕시화바륨(Ba(C2H5O)2)이 된다. 바륨이온은 무색이고 유독하다. 황산바륨은 백색으로 매우 물에 녹기 어려우므로 바륨이온의 검출이나 정량(定量)에 이용 되며, 백색안료로 쓰인다. 또 체내에 들어가도 안전하므로 X선 조영제(造影劑)로 쓰인다. 이 밖에 탄산염 · 크롬산염 · 옥살산염 등에 녹기 어렵지만 산에는 녹는다. 할로겐화물 · 질산염 등은 물에 녹지만 일반적으로 칼슘염과 같이 흡습 · 조해성(潮解性)에서는 녹지 않는다. 수산화물도 녹으며 강알칼리성이다. 염류는 녹색의 불꽃반응을 보인다.
〔제조 방법〕 중정석을 탄소와 함께 600~800℃로 가열하여 황화바륨을 만든다.
BaSO4 + 2C → BaS + 2CO2
이것을 염산으로 분해시키면 염화바륨이 된다.
BaS + 2HCl → BaCl2 + H2S
이 염화바륨의 수용액을 수은을 음극으로 전기분해하면 바륨과 수은의 합금(바륨아말감)이 생긴다. 이들을 진공에서 증류하여 수은을 제거하면 금속 바륨을 얻는다. 또는 탄산바륨(BaCO3)을 탄소와 함께 강열(强熱)하여 산화바륨(BaO)을 만들고 BaCO3 + C → BaO + 2CO 이 산화바륨을 진공 중에서 알루미늄 또는 규소와 1,200℃로 가열하여 환원해도 얻을 수 있다.
3BaO +2Al →3Ba + Al2O3
2BaO + Si → 2Ba + SiO2
금속바륨은 불과 반응하여 수소를 발생하고 수산화바륨(Ba(OH)2)이 된다.
Ba+2H2O → Ba(OH)2+H2
또한 에틸알코올과도 같은 형태의 반응을 하여 알콕시화바륨(Ba(C2H5O)2)이 된다. 바륨이온은 무색이고 유독하다. 황산바륨은 백색으로 매우 물에 녹기 어려우므로 바륨이온의 검출이나 정량(定量)에 이용 되며, 백색안료로 쓰인다. 또 체내에 들어가도 안전하므로 X선 조영제(造影劑)로 쓰인다. 이 밖에 탄산염 · 크롬산염 · 옥살산염 등에 녹기 어렵지만 산에는 녹는다. 할로겐화물 · 질산염 등은 물에 녹지만 일반적으로 칼슘염과 같이 흡습 · 조해성(潮解性)에서는 녹지 않는다. 수산화물도 녹으며 강알칼리성이다. 염류는 녹색의 불꽃반응을 보인다.
〔제조 방법〕 중정석을 탄소와 함께 600~800℃로 가열하여 황화바륨을 만든다.
BaSO4 + 2C → BaS + 2CO2
이것을 염산으로 분해시키면 염화바륨이 된다.
BaS + 2HCl → BaCl2 + H2S
이 염화바륨의 수용액을 수은을 음극으로 전기분해하면 바륨과 수은의 합금(바륨아말감)이 생긴다. 이들을 진공에서 증류하여 수은을 제거하면 금속 바륨을 얻는다. 또는 탄산바륨(BaCO3)을 탄소와 함께 강열(强熱)하여 산화바륨(BaO)을 만들고 BaCO3 + C → BaO + 2CO 이 산화바륨을 진공 중에서 알루미늄 또는 규소와 1,200℃로 가열하여 환원해도 얻을 수 있다.
3BaO +2Al →3Ba + Al2O3
2BaO + Si → 2Ba + SiO2
- 다음
- 바륨화합물 [barium compound] 2017.11.28
- 이전
- 바닐린 [vanillin] 2017.11.28






























