이온 (ion)
 2017-11-01
2017-11-01
이온은, 분자나 원자가 전하를 띠고 있는 것을 의미한다.
원자의 양성자 수는 일반적인 화학변화에 의해서 변화되거나 하지 않지만, 음전하를 나타내는 전자들은 감소하거나 증가될 수 있다. 이러한 이유로 원자에서 전자를 잃게 되면 원자는 양전하를 나타내며 전자를 얻게 되면 음전하를 띠게 된다. 양전하를 띤 이온을 양이온(cation)이라 하며, 음전하를 띤 이온은 음이온(anion)이라 부른다.
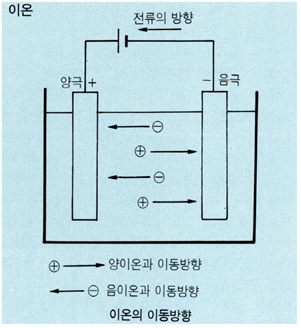
하전(荷電)된 원자 또는 원자단. 중성원자나 원자단(분자를 포함)이 하나 또는 몇 개의 전자를 잃거나 얻음으로써 생기는 입자이다. 전해질, 예를 들면 염화나트륨(NaCI) 수용액에 직류전류를 통하면 저전위극(低電位極 ; 음극)을 향해 나트륨 원자가 이동하고 고전위극(양극)을 향해 염소 원자가 이동한다. 이 현상을 영국의 M. 패러데이는 나트륨 원자가 양전하를 가지며 염소 원자가 음전하를 가지기 때문이라 설명하고 이러한 전하를 가진 원자를「이동한다」는 뜻의 그리스어 ionai에서 따서 ion이라 명명했다. 그 후 전자의 존재나 원자의 전자구조 등의 연구가 진전되어 이온이란 중성원자 또는 원자단 이 정수개(整數個)의 전자를 얻거나 잃음으로써 생긴다는 것이 밝혀졌다. 이와 같은 과정에서 이온이 되는 것을 이온화라고 한다.
〔양이온과 음이온〕 양전하수가 과잉된 것, 즉 중성원자 또는 원자단에서 전자가 상실된 것을 양이온(cation)이라 하고 음전하수가 과잉인 것, 즉 중성원자 또는 원자단에 전자가 더해진 것을 음이온(anion)이라 한다. 중성분자라 하더라도 양이온 부분과 음이온 부분을 포함하는 구조를 가진 것이 있는데 이것을 양쪽성 이온이라고 한다. 아미노산은 그 분자 중에 아미노기(-NH2)와 카르복시기(-COOH)를 가지는데 수용액 속에서나 결정 속에서 양쪽성 이온이 되기 쉽다.
NH2-R-COOH → NH3+-R-COO-
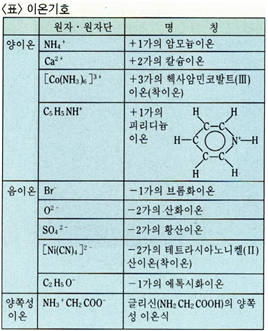
이온은 그 바탕이 되는 원자 또는 원자단의 화학기호 오른쪽 어깨에 얻거나 잃은 전자의 개수를 부호와 함께 표시한 기호, 즉 이온 기호로 표시한다. 얻거나 잃은 전자의 개수는 이온가(價)이며 일반적으로 +n가의 양이온은 Mn+라 표시하고, -n가의 음이온은 Xn- 라 표시한다. n+ 대신 +n을, n- 대신에 – n을 사용하거나, 이 외에 +나 -를 가수(價數)만큼 열기하는 방법(Fe+++, SO4–)도 있으나 지금은 정식표기법이 아니다. 이온 1개가 가진 전기량은 전자 한개가 가진 전기량의 절대값(전기소량)의 이온가배(倍)가 된다.
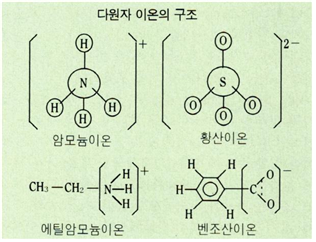
〔다원자이온의 구조〕 암모니아 분자에 수소이온이 첨가되면 암모늄이온이 생긴다.
NH3 + H+→ NH4
그 구조는 메탄(CH4)과 같은 정사면체형인데, 네 개의 수소원자 중 어느 것이 H+인지 구별할 수 없다. NH4원자단이 전체로서 +1가의 양이온으로 되어 있는 것이다. 마찬가지로 황산(H2SO4)에서 생기는 황산이온(SO42-)에서도 그 구조는 정사면체형이며 네 개의 산소원자는 등가이다. 한편 알킬아민 · 카르복시산 같은 유기전해질에서는 각 작용기(作用基)만 이온화한 것으로 보이며, 분자 전체에 균등한 전하분포가 있는 것은 아니다.



- 다음
- 쟈크 샤를 (Jacques Alexandre Cesar Charles 1746 ~ 1823) 2017.11.01
- 이전
- 스티븐 호킹 (Stephen William Hawking, 1942 ~ ) 2017.11.01














![[핫클립] 전류가 통하는 음식들로 푸드피아노 만들기](/jnrepo/uploads/2023/06/hqdefault-6-16.jpg)
![[핫클립] 전기로 글씨가 써지는 원리는 무엇일까?](/jnrepo/uploads/2023/06/hqdefault-12-6.jpg)

















