수소결합 (hydrogen bond, 水素結合)
 2017-11-01
2017-11-01
수소 원자는 원자핵(양성자)의 주위에 한 개의 전자만 있어 질소·산소·플루오르 등 다른 전기음성도(電氣陰性度)가 큰 원자와의 화학 결합에 그 전자를 사용하면 그 전자는 상대 원자에 끌려 자신은 양으로 대전된 원자핵이 되기 쉽다. 또 근처에 음성이 강한 다른 원자가 있으면 이것과 맞당겨서 약하지만 결합을 이룬다. 이와 같은 결합을 수소결합이라고 한다.
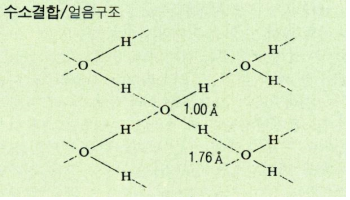
보통의 공유결합에 비해 강도는 1/10 정도지만 고체나 액체 속에서 분자 상호간의 배향(配向)을 결정할 정도의 결합력이다. 가장 가까운 예는 물이나 얼음에 나타난다. 얼음은 물보다 밀도가 작으며 공극(空隙)이 많은 결정 구조를 하고 있음에도 불구하고 융해 열(6.01KJ/mol)에 비해 승화열(45.05KJ/mol)이 큰 것은 물분자 상호간에 반데르발스 힘(분자간힘) 이상의 힘으로 수소결합이 존재하기 때문이다. 이 밖에 유전율이 큰 것, 0K로 되어도 엔트로피가 유한값(3.4J/mol/K)을 가지는 경우도 수소결합 때문이다.
또 포름산·아세트산·벤조산 등의 유기산이 이합체(二合體)를 형성하기 쉬운 것도 수소결합에 의해 설명된다. 수소결합은 또 탄수화물·단백질·DNA 등 생체물질의 생체내 존재상태나 생체화학적 과정에서 중요한 역할을 한다. 수소결합에 의해 응집된 상태에서는 때로 공유 결합과 수소 결합을 한꺼번에 갈아치워 많은 등가상태를 얻는 경우가 있고 그 때문에 강유전성을 보이는 경우도 있다.

- 다음
- 루이스 앨버레즈 [Luis Walter Alvarez, 1911.6.13 ~ 1988.9.1] 2017.11.01
- 이전
- 수렴영역 (region of convergence, 收斂領域) 2017.11.01






























