루비듐(rubidium)
 2017-06-20
2017-06-20
[요약] 주기율표 1족 5주기에 속하는 알칼리 금속원소로 원소기호 Rb, 원자량 85.468g/mol, 녹는점 39.31℃, 끓는점 688℃, 밀도 1.53g/cm3이다.
원소기호 Rb, 원자번호 37, 원자량 85.4678±3, 지각 중의 존재도 90ppm(21위), 안정핵종 존재비 85Rb=72.15%, 87Rb=27.85%, 녹는점 38.89℃, 끓는점 688℃, 액체의 비중 1.475(39℃), 고체의 비중 1.53(20℃), 전자배치[Kr] 5s1, 주요 산화수 1이다.
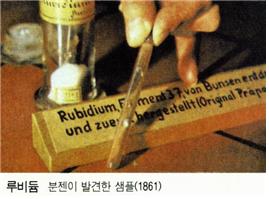
주기율표 1A족에 속하는 알칼리금속원소의 하나. 1861년에 R. W. 분젠과 G. R. 키르히호프가 인운모(鱗雲母)에서 추출한 알칼리금속 염화백금산염 속에서 발광스펙트럼에 의해 발견되었다. 홑원소물질은 염의 용융전해에 의해 분젠이 처음 단리했다. 다른 알칼리금속에 수반되어 극히 소량 산출된다. 인운모 속에 비교적 많이 함유되어 있으며, 광천수 속에 나타나는 경우도 있다. 식물재(灰) 속에 칼륨과 함께 미량 함유된다.
[성질] 백색의 연한 금속이다. 체심등축격자이며, 비열은 0.0711cal/K · g, 융해열은 6.1cal/g, 비저항1.2×10-6Ωcm(0℃)이다. 고순도의 루비듐염은 홍자색의 담색을 띤다. 양성(陽性)이 강한 원소이며, 홑원소물질의 반응성은 세슘 다음이다. 기체는 청색으로 상온의 공기 속에서 곧바로 산화되어 산화물 Rb2O가 되고, 과잉 산소와의 반응에서 초산화물 RbO2를 발생한다. 할로겐과는 직접 반응하며 물과 격렬하게 반응하여 수소를 발생하고 수산화물 RbOH가 된다. 산 · 에틸알코올과는 수소를 발생하여 대응하는 염 또는 에톡시화물을 만든다. 액체 암모니아에 녹아 용매화전자 e-NH의 청색이 되지만 시간과 함께 아미드 RbNH2로 변한다. 전기음성도는 0.8, 산화전위 E0=2.99V(Rb(금속) → Rb+(물)+e-)이다. 공기와의 접촉을 피해 석유 · 파라핀유 속에 보존한다.
[제법] 니크롬산루비듐(Rb2Cr2O7)의 지르코늄에 의한 진공가열환원 및 아지드화루비듐(RbN3)의 진공가열에 의한다. 공업적으로 인운모에서 리튬제조 때 부산물로 채취되며 염화물을 금속 칼슘 등에서 759℃ 로 감압환원시켜 얻는다. 광전지의 원료인 87Rb은 암석의 연대측정에 이용된다.

- 다음
- 루이스 산·염기(Lewis acid-base) 2017.06.20
- 이전
- 무질서도(degree of disorder, 無秩序度) 2017.06.20













![[핫클립] 금속을 동그랗게 만들기 위해 필요한 전기적 방전 장치](/jnrepo/uploads/2023/05/hqdefault-8-18.jpg)
![[핫클립] 발상의 전환으로 물질 부양 실험 성공](/jnrepo/uploads/2023/05/hqdefault-6-13.jpg)

















