과산화황산[peroxosulfuric acid, 過酸化黃酸]
 2016-08-24
2016-08-24
황산의 S원자에 배위되어 있는 O2-를 O22-로 치환한 것이다. 다음 2종이 가장 널리 알려져 있다.
① 과산화일황산 : 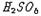 .
카로산이라고도 한다. 30℃ 이하에서 진한 황산에 전류를 흐르게 함으로써 전기분해하여 얻는 과산화이중황산을 가수분해하거나, 차고 진한 황산에 과산화수소를 작용시키면 용액으로 얻을 수 있다. 또 클로로황산 HSO3CI에 과산화수소를 조금 과량 작용시켜 생성한 염화수소를 제거하면 무색 투명한 결정으로 얻을 수 있다.
.
카로산이라고도 한다. 30℃ 이하에서 진한 황산에 전류를 흐르게 함으로써 전기분해하여 얻는 과산화이중황산을 가수분해하거나, 차고 진한 황산에 과산화수소를 작용시키면 용액으로 얻을 수 있다. 또 클로로황산 HSO3CI에 과산화수소를 조금 과량 작용시켜 생성한 염화수소를 제거하면 무색 투명한 결정으로 얻을 수 있다. 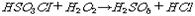 . 녹는점 45℃ 알코올·에테르·아세트산에 쉽게 녹는다. 흡습성이 있고 산화력이 강하다. 벤젠·페놀 등의 유기물을 폭발적으로 산화시키고 과산화이중황산보다 더 빨리 아이오딘화칼륨을 산화시킨다. 강한 1가산. 과망가니즈산칼륨과의 혼합물은 강한 산화제로서 아닐린을 니트로벤젠으로 산화시킨다.
② 과산화이중황산 : H2S2O8 .
진한 황산을 전기분해하면 수용액으로 얻어 클로로황산 2몰과 과산화수소 1몰의 반응에서 무색 결정으로 얻을 수 있다. 오존과 같은 냄새를 가진 흡습성 결정, 녹는점 65℃. 산화력이 크고, 알코올·에테르와는 폭발적으로 반응한다. 말리면 안정적이다.
. 녹는점 45℃ 알코올·에테르·아세트산에 쉽게 녹는다. 흡습성이 있고 산화력이 강하다. 벤젠·페놀 등의 유기물을 폭발적으로 산화시키고 과산화이중황산보다 더 빨리 아이오딘화칼륨을 산화시킨다. 강한 1가산. 과망가니즈산칼륨과의 혼합물은 강한 산화제로서 아닐린을 니트로벤젠으로 산화시킨다.
② 과산화이중황산 : H2S2O8 .
진한 황산을 전기분해하면 수용액으로 얻어 클로로황산 2몰과 과산화수소 1몰의 반응에서 무색 결정으로 얻을 수 있다. 오존과 같은 냄새를 가진 흡습성 결정, 녹는점 65℃. 산화력이 크고, 알코올·에테르와는 폭발적으로 반응한다. 말리면 안정적이다.
- 다음
- 과염소산[perchloric acid, 過鹽素酸] 2016.08.24
- 이전
- 과산화탄산염[peroxocarbonate, 過醒化候醒醒] 2016.08.24













![반도체 공정이 핵심 원료, 불화수소 공정 과정 [#핫클립]](/jnrepo/uploads/2021/09/반도체-공정이-핵심-원료-불화수소-공정-과.jpg)

















